肿瘤研究:剖析“癌中之王”,掌握“胰腺生机” | 时空简讯44期
- 来源:时空组学
- 阅读量:830
- 发表时间:2023-03-20
胰腺位于腹膜后,“头部”位于十二指肠弯曲的凹处,“躯干”在胃的正后方,“尾部”则延伸至脾脏。虽然在身体中的位置很深、很隐蔽,但胰腺却是人体代谢正常运行的“发动机”,具有强大的内分泌和外分泌功能。一旦胰腺内外分泌功能受损,会导致慢性或急性胰腺炎、2型糖尿病,甚至胰腺癌(主要指胰腺导管腺癌)。而胰腺癌被称为“癌中之王”,一旦发病,致死率极高。
据国家癌症中心最新统计数据显示,2000-2016年我国胰腺癌总体发病率和死亡率呈逐年上升趋势,2016年胰腺癌总体发病数(10.0万)和病死数(8.8万)分别居恶性肿瘤第十一位和第七位,死亡发病比高达0.88,在所有常见肿瘤中位列第一,表明了胰腺癌极高的恶性程度和不良预后。若能做到早预防、早诊断、早治疗,可以大幅提升胰腺癌患者的生存期。在此,我们遴选了有关胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)发病机制、诊断与治疗反应的8篇优质前沿文章,展示了空间及单细胞组学技术在PDAC病理与诊疗方面取得的最新成果,供了解参考。
综述
Review
利用单细胞和空间技术进一步揭示胰腺癌进展及其治疗反应的分子机制
① 简要总结了bulk基因组和转录组技术在人类PDAC研究中取得的进展,并解释了bulk mRNA研究面临着区分肿瘤隔室与微环境中其他细胞类型贡献的挑战,这在PDAC中更加突出。
② 讨论了利用单细胞和空间技术阐明PDAC肿瘤组织中恶性细胞、癌症成纤维细胞和免疫细胞异质性的研究进展。尽管单细胞技术在胰腺癌中的应用普遍落后于其他肿瘤(部分原因是难以从酶促降解组织中提取高质量RNA),但此类研究现在正在迅速兴起。
③ 鉴于患者即使在可切除的疾病中也经常接受新辅助化疗和/或化放疗,利用单细胞和空间技术等生物新技术破译富含细胞毒性治疗或由细胞毒性治疗诱导的基因程序,对于深入了解旨在根除残留癌细胞的补充治疗至关重要。
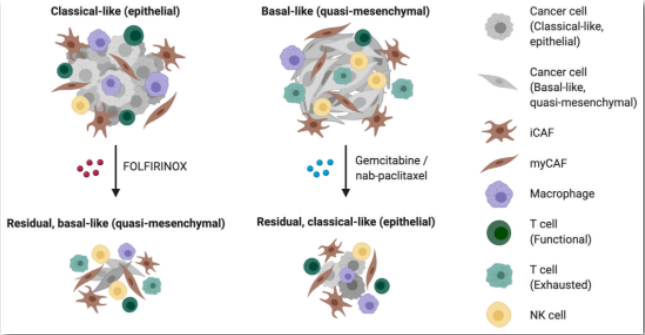
PDAC中对治疗的潜在转录组亚型依赖性反应、不同细胞类型之间的关联,以及治疗诱导的可塑性
病理机制
Pathological Mechanism
人类胰腺癌进展的两个关键过渡点的细节新见解
① 该研究为人类肿瘤图谱网络(the Human Tumor Atlas Network consortium)的一部分,通过使用单细胞/核RNA-seq、bulk蛋白质基因组学、空间转录组学和细胞成像技术,研究来自31例PDAC患者的83个样本,揭示了胰腺癌发生的两个关键过渡点(即从正常细胞到癌变前细胞的转变,以及从癌变前细胞向胰腺癌细胞的转变)的细节信息,并阐释了癌细胞对疗法耐受性的分子机制,以及如何利用特殊的免疫疗法来治疗恶性肿瘤类型。
② 鉴定并验证了从正常胰腺到PDAC的过渡populations,包括腺泡到导管化生(acinar-to-ductal metaplasia,ADM)和胰腺上皮内瘤变(pancreatic intraepithelial neoplasia,PanIN)细胞,以及未转化的腺泡、导管细胞、PDAC细胞群。
③ 与肿瘤细胞相比,ADM细胞群同时表达癌基因和抑癌基因,显著上调上皮-间质转化和干细胞基因;化疗耐药样本中含有三倍富集的炎症性癌症相关成纤维细胞,可上调金属硫蛋白。
④ TIGIT在耗竭和调节性T细胞中高表达,而NECTIN家族基因在肿瘤细胞中高表达,但在不同PDAC患者之间存在显著异质性。
通过整合空间转录组和scRNA-seq揭示胰腺导管腺癌的组织结构
① 通过引入多模式交叉分析(multimodal intersection analysis,MIA)将来自两例PDAC患者肿瘤组织的空间转录组(ST)和scRNA-seq数据进行整合,描述了肿瘤微环境中不同细胞类型和亚群的位置,以及癌症亚区域内细胞类型之间的关系。
② 用scRNA-seq鉴定两例未经治疗的PDAC患者中的细胞群,在PDAC-A和PDAC-B中分别确定了15和11种细胞亚群(cluster);PDAC-A中的两个cluster和PDAC-B中的一个cluster显示异常的拷贝数变异,通过双重免疫荧光染色验证单细胞测序数据中检测到的TM4SF1可作为PDAC标志物。
③ 同一PDAC肿瘤组织的2个组织切片用于ST分析,然后用MIA方法将scRNA-seq和ST数据集进行整合分析,发现PDAC-A患者中的所有导管亚群都富集在组织的导管区域;只有缺氧和晚期导管细胞群在癌症区域显著丰富,而PDAC-B中的导管亚群都完全富集于导管上皮区域。
④ 创建第三个PDAC单细胞数据集用于对肿瘤微环境中细胞状态的关系进行解卷积,发现炎性成纤维细胞、单核细胞和T/NK细胞在应激反应模块区域大量富集;综合TCGA的PDAC数据,发现炎症性成纤维细胞和表达应激基因模块的癌细胞在空间上紧密相连。
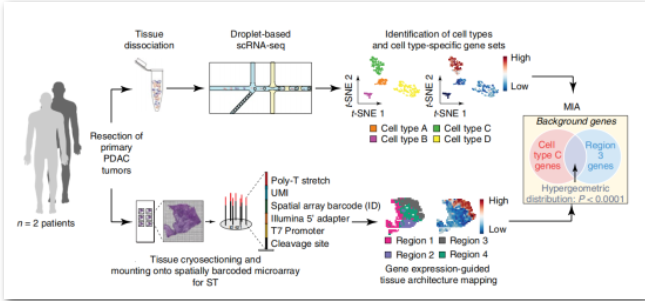
两例PDAC患者肿瘤样本的scRNA-seq和ST分析示意图
消化道癌中新抗原反应性T细胞的转录组图谱
① 选取5例胆管癌和5例胰腺癌患者,通过体外免疫筛选试验鉴定和分选出浸润胆管癌和胰腺癌的新抗原反应性T细胞,并应用scRNA-seq技术表征了新抗原反应性肿瘤浸润淋巴细胞(tumor-infifiltrating lymphocytes,TIL)的转录组图谱,为细胞免疫治疗提供新的见解。
② scRNA-seq获得1,659个CD8+T细胞和1,441个CD4+T细胞的数据,共聚类为12个细胞簇;大多数CD8+和CD4+新抗原反应性TIL呈现耗竭状态,如高表达PDCD1基因。
③ 与非新抗原特异性的旁观激活CD8+T细胞相比,CD8+新抗原反应性TIL共表达CXCL13和GZMA基因;CD4+新抗原反应性TIL过表达CXCL13基因、HOPX或ADGRG1基因,而不表达IL7R基因。
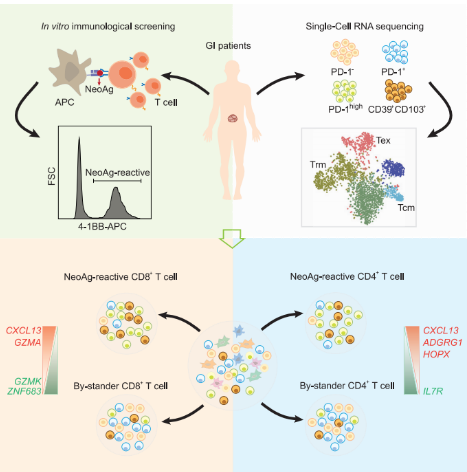
试验设计及主要结果
诊断与治疗
Diagnosis and Treatment
胰腺癌的单核和空间转录组分析确定与新辅助治疗相关的多细胞动态变化
① 使用snRNA-seq和全转录组数字空间分析来自43例接受新辅助治疗(n=25)或未经治疗(n=18)的原发性PDAC患者的肿瘤样本,构建了组成PDAC的细胞亚型和空间群落的高分辨率分子景观,揭示了PDAC肿瘤间和肿瘤内的多样性、离散群落的空间组织、治疗相关的重塑和临床相关的预后。
② 发现了细胞组成和表达程序的治疗相关变化,包括新发现的神经样祖细胞恶性细胞程序,该程序在化疗和放疗后富集,并在独立队列中与不良临床结果相关。
③ 通过将细胞类型特征和表达程序与匹配样本的空间转录组数据进行整合,揭示了3个具有不同恶性、成纤维细胞和免疫特征的多细胞亚群:治疗丰富亚型1、鳞状细胞-基底细胞样亚型2和经典细胞样亚型3。
④ 空间定义的细胞间受体-配体相互作用在治疗后残留肿瘤中富集增强,这是改善胰腺癌新辅助和辅助治疗的潜在靶点。
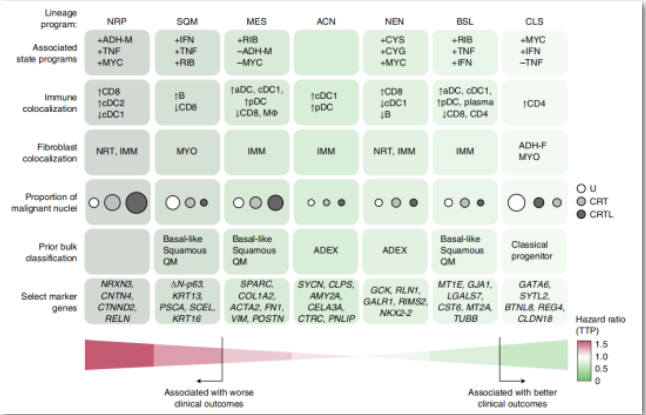
PDAC的精细分子分类学
scRNA-seq揭示化疗对人胰腺癌及其肿瘤微环境的影响
① 在化疗前后收集27例PDAC患者的新鲜肿瘤样本并进行scRNA-seq分析,系统地描述了人类PDAC的结构组成,确认了化疗会严重影响PDAC的肿瘤微环境(tumor microenvironment,TME),并可能通过减少抑制性检查点分子表达和涉及CD8+T细胞的相互作用导致对免疫疗法的进一步抵抗。
② 恶性上皮细胞存在显著的异质性,并发现了具有基础和经典癌细胞亚型的异质混合物,以及不同的癌症相关成纤维细胞和巨噬细胞亚群。
③ 经典和基底样癌细胞对化疗表现出相似的转录反应,并且在处理过的样本中没有表现出向基底样转录程序的转变。
④ 化疗会降低PDAC中抑制性检查点分子的表达和配体-受体的相互作用,特别是CD8+T细胞上的TIGIT与其在癌细胞上的受体之间的相互作用,并将TIGIT鉴定为CD8+T细胞的主要抑制性检查点分子。
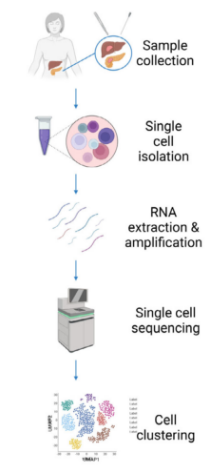
PDAC样本采集、处理和分析的工作流程
缺氧微环境诱导胰腺癌空间转录组变化
① 在小鼠缺血后肢中建立了人类PDAC移植物,并基于空间转录组和scRNA-seq分析,首次描述了缺氧微环境诱导的PDAC空间基因表达变化,并确定了PDAC的潜在治疗靶点,为进一步研究缺氧性肿瘤的预后和治疗奠定了基础。
② 空间转录组分析显示,与对照组(9个亚群)相比,缺氧组肿瘤细胞亚群减少到7个;GO富集分析显示,对照组亚群表现出位置特征和不同的基因特征。
③ 位于侵袭前沿的亚组6在缺氧条件下表现出更高的增殖能力,其标记基因在细胞增殖、侵袭和应激反应方面富集。
④ 基于缺氧组和对照组的空间转录组特征,CMAP(the Connectivity Map)分析表明,缺氧组中侵袭性最强的亚组6对PI3K抑制剂ADZ-6482敏感。

缺氧组和对照组PDAC肿瘤依赖簇候选药物的比较
基于细胞外囊泡蛋白血液检测的早期多癌检测
① 根据细胞外囊泡(extracellular vesicles,EVs) 蛋白(13中EVs蛋白)图谱开发了一种基于血液EVs的生物标志物分类器,并证实其能够快速、准确地检测出早期胰腺癌、卵巢癌或膀胱癌,有望成为胰腺癌及其他癌症的新型早期诊断方法,推动癌症早筛发展,提高癌症患者的整体存活率。
② 基于EV的多癌症检测方法是利用基于交流电动力学(alternating current electrokinetic,ACE)的高导电双电泳平台,从患者血浆中纯化EVs,再通过多标记EV蛋白测量开发出机器学习算法,来辨识和并分类EVs中的生物标记物蛋白。
③ 将代表胰腺癌、卵巢癌或膀胱癌患者的139例经病理证实的I期和II期癌症病例与184名对照受试者进行比较分析,基于EV的多癌症检测方法成功预测了早期I~II期胰腺癌、卵巢癌和膀胱癌的存在,其灵敏度为71.2%(95% CI:63.2~78.1),特异性为99.5%(97.0~99.9),曲线下面积为0.95(95% CI:0.92~0.97)。
④ 两个早期阶段的敏感性相似[第一阶段:70.5%(60.2~79.0);第二阶段:72.5%(59.1~82.9)];I期癌症的检出率在胰腺癌中达到95.5%,在卵巢癌中达到74.4%(在IA期中达到73.1%),在膀胱癌中达到43.8%。
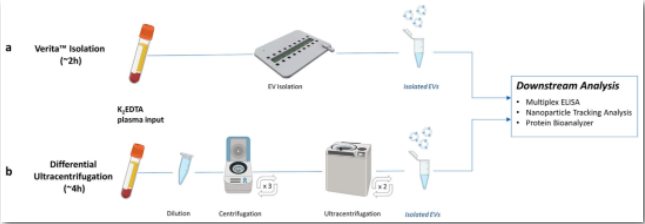
使用Verita™或超离心法的EV纯化工作流程
版权声明:
本网站所有注明"来源:华大集团"或“来源:华大医疗”的文字,图片和音视频资料,版权均属于华大集团所有。非经授权,任何媒体,网站或个人不得转载,授权转载时须注明“来源:华大集团”。本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权,或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




