基因治疗里的七龙珠
- 来源:中吉智药
- 阅读量:889
- 发表时间:2023-03-22
经过一个阶段的思考和讨论,我们决定撰写以基因治疗、尤其是经典的基因递送疗法为主题的系列科学普及类文章。通过这个系列文章,我们希望达到三个小目标。首先,基因治疗的相关概念逐渐被人们熟知,但一些基本概念又有不少理解上的偏差,我们期望能帮助明晰基因治疗的相关概念。其次,可以让我们自己更有效的和同行及市场进行交流。另外,更进一步的,我们期望这个系列文章能起到入门读物的作用,让有兴趣的读者对行业和技术的发展历程有个总览又准确的认知。下面的文章,就是这个系列的第一篇。
从临床症状表现的严重程度看,可简单分为轻型、中间型、重型等三类。重型地贫严重威胁健康,甚至致残致死。轻型地贫大多无临床症状,仅在实验室检查结果上异常,生活和常人无异。中间型地贫临床表型变化范围巨大,轻重不一:轻者无明显症状,重者需要定期输血,出现肝脾肿大、皮肤黄疸、骨骼改变等表型,呈现特殊的“地贫面容”。中间型地贫的治疗方案最为复杂。
医学和分子遗传学的研究早已清楚表明,地贫是由于珠蛋白基因突变而引起的一组常染色体遗传病。人体依靠红细胞中的血红蛋白来运输氧气,血红蛋白由珠蛋白和血红素组成,其中珠蛋白以四聚体形式存在,由两个α珠蛋白和两个β珠蛋白组成,两种珠蛋白对应的α珠蛋白基因和β珠蛋基因均可突变,导致血红蛋白数量减少甚至缺失,对应的疾病即是α地贫和β地贫。
现有的地贫治疗方法,主要有两类:对症治疗的长期输血,和根治的造血干细胞移植。
其一,输血,可以在一段时间内维持血红蛋白浓度接近正常水平,保障机体携氧能力。长期输血的负面影响,除了沉重的经济负担,更严重的是会导致体内铁大量积累,沉积在心脏、肝脏、胰腺等器官,引起损伤和并发症。输血面临的最大困难是血荒,即无血可输。
其二,造血干细胞移植,该技术已较为成熟,临床效果很好,但也有费用昂贵(年费用40万)和后期免疫排异反应等问题。目前造血干细胞技术临床应用的困境,除了配型成功率低的问题外,移植仓数量少、供应量无法满足患者需求也是一个显著难点。据统计,截至2021年4月1日,我国完成地贫患者的造血干细胞移植3969例,其中排名第一的是广西医科大学第一附属医院,完成了871例。对于我国30万需要长期输血或进行造血干细胞移植的重型、中间型地贫患者,现有的医疗供应能力实属杯水车薪,治疗需求远未被满足。
在科学技术飞速发展的今天,是否存在可以突破传统方法局限,根治地中海贫血的手段?还真有!那就是基因治疗。
真有说的这么简单就好了!这个思路,是典型的“说着轻巧”的描述,实施起来,实在不是一般的复杂。从1990年,FDA(美国食品药品监督管理局)批准全球首个人体基因治疗的试验开始,经过30多年,截至2021年8月,仅有七款针对遗传病的基因治疗药物上市,均基于经典的基因递送疗法,具体情况见表1。
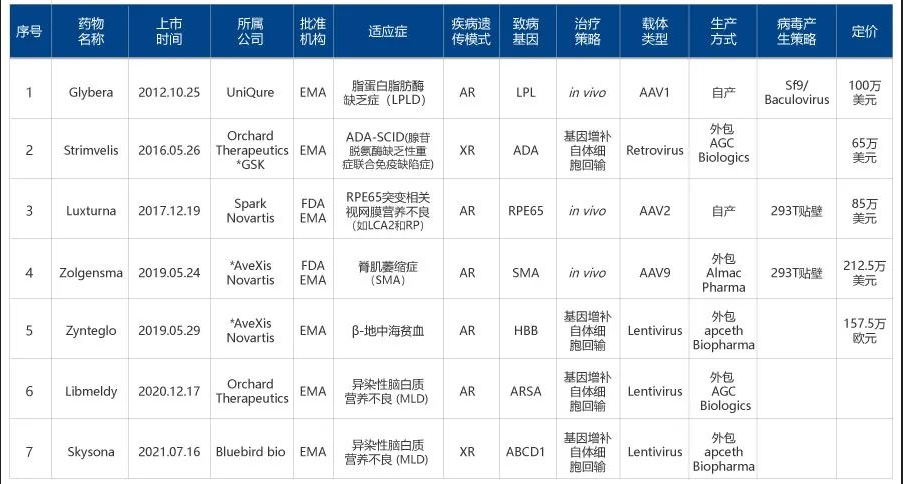
表1 已上市的7款单基因遗传病基因治疗药物
注释:疾病遗传模式,AR (常染色体隐性),XR(X染色体隐性)
30多年,只有7款药物上市,且其中两款因为销量低迷,已经退市。这足以说明,成功开发并获批销售一款基因治疗药物,极为不易。根据现有技术条件和此前成功经验,一款基于经典基因递送疗法开发的基因治疗药物要达到上市销售的标准,至少要依次成功的迈过如下七大关卡,缺一不可。
第二,充分明晰致病基因的表达调控。如若不然,就无法设计合适的基因表达盒,这一点是如此的显而易见,以至于许多人视而不见。至少有两点值得重视。首先,人类有2万多个编码基因,每个基因性格各异,互相之间关系复杂。导致SMA(脊髓性肌萎缩症)的SMN基因(运动神经元存活基因),体量小(仅编码294个氨基酸),表达调控简单明了,其基因治疗药物Zolgensma的开发过程,是一个典型的弯道超车,后来者居上的例子。但如果要开发前述的β-地中海贫血基因治疗药物,那就意味着要面对人类的表达调控最复杂基因之一的珠蛋白基因。在个体发育阶段,珠蛋白基因簇在基因座调控区(Locus Control Region,LCR)的调节下,按胚胎、胎儿、成年的发育时间顺序表达不同的珠蛋白基因(图2)。如果不清楚这个元件的功能,是不可能开启针对地贫的基因治疗的。值得一提的是,LCR区中的HS2和HS3,由我国基因治疗和基因表达调控领域的前辈刘德培院士在上世纪80年代发现并证实。其次,基因的表达有组织特异性和时空顺序。每个体细胞都包含整套的人类基因,人体有200多种细胞,由于基因的组织特异性表达调控,这些细胞才能发挥不同的功能。有些基因仅在特定组织和细胞中表达,比如珠蛋白基因;或者多种细胞都有表达但仅在受累组织中功能明显,比如SMN基因;有些基因在不同组织细胞中均有表达且有重要功能,比如MYH7基因,同时是HCM(肥厚性心肌病)和CMT(腓骨肌萎缩症)的重要致病基因,在心肌和骨骼肌中均有表达。基于以上两个特点,设计基因治疗方案时必须非常谨慎,不能跑偏,如果错误的干预了正常细胞,后果不堪设想。
针对β-珠蛋白基因异常的基因递送疗法药物LentiGlobin(商品名称Zynteglo),集中体现了人们在珠蛋白基因表达调控领域几十年积累的研究及应用高度,该药物于2019年5月经EMA(欧洲药品管理局)批准上市销售,是基因治疗发展历史上的一个重要里程碑。
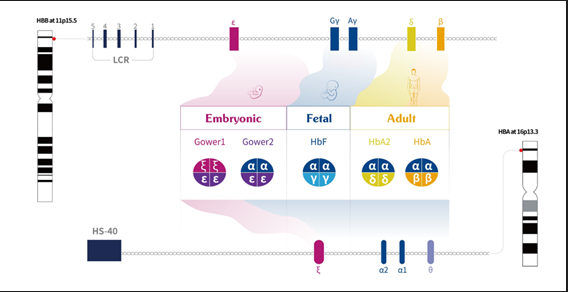
图2 珠蛋白基因表达调控示意图
第三,找到并使用合适的基因递送工具。递送工具,显然是基因治疗的关键要素。目前最为人们熟知的基因递送工具,是病毒载体。病毒载体的发现、改造、优化和应用,是一个漫长艰辛的过程,需要非常深厚的病毒学、载体学知识,非真强人不能为,该领域出现了许多“大牛级”分子生物学家。基因治疗中常用的病毒载体有AAV(腺相关病毒)、LV(慢病毒)、反转录病毒载体、腺病毒载体和疱疹病毒载体等。每种载体都有其优势和局限,适用于不同的治疗目的。以AAV载体为例,从1965年由Atchison等发现并定义AAV开始,经过半个多世纪的发展,现已成为最具应用前景的病毒载体。不同血清型的AAV载体具有不同的组织特异性、靶向特性和表达特性,总数可能多达数百种。根据目的疾病的致病机制,选择和自己改造筛选合适的AAV,是极其重要的工作。从表1可以看出,直接体内基因治疗策略(in vivo)都使用AAV载体作为递送工具,有3款药物,分别采用了AAV1、AAV2、AAV9等三种不同血清型;间接体内基因治疗策略(ex vivo)大部分采用LV载体作为递送工具,也有3款药物上市。
第四,基因治疗药物的初步成型和筛选。基因治疗药物的本质,就是一个恰当的病毒载体,装载了一个合适的基因表达盒。这个组合和航天工程中的火箭卫星系统非常相似:病毒载体好比火箭,负责将基因表达盒这个卫星精准高效的送到人体太空的指定组织或细胞中,行使预定的功能。这一步中,如何完成精细巧妙的组装,且需要反复摸索和测试,最见功力。以LentiGlobin为例,LV载体即是火箭,负责递送;基因表达盒就是卫星,负责到达造血干细胞这个指定位置后行使预定功能,表达正常的β珠蛋白,修复贫血症状。这个火箭和卫星,和现实中一样,每家各有绝活,都有一定特色,也都在努力争取生产出自己的产品。虽然极其复杂,但珠蛋白基因的表达调控机制比较清晰,也恰好有其他关联基因的负向调控机制,所以β地贫是基因治疗的热门目标。事实上,β-地中海贫血的基因治疗药物,据公开资料,包括基因编辑技术在内,国内外目前还有至少9家机构在积极开发。
第六,基因治疗药物的生产制造。基因治疗药物的呈现形式是病毒载体,属于生物制品,制造过程和传统化学药品差异巨大,存在自身特有的难点:不能消毒灭菌(药物本身就是具有活性的病毒载体),很难自动化,不同生产批次之间性状品质有差异,质检环节非常复杂,流程周期更长久,成本高昂等等。这些困难持续困扰着产业界,尤其是成本高昂,甚至直接限制了已上市药物的可及性。同时,催生了一个专门的、欣欣向荣的行业:CDMO。这和造车新势力有些相似,大部分新兴车企都不具备造车能力,而采用代加工的方式,和传统车企合作,生产制造投放市场。从技术流程上看,基因治疗药物的生产制造包括病毒载体产生方法和生产制造工艺两大环节,其中产生方法对制造成本的影响是根本性的。以AAV为例,现有的病毒载体产生技术有如下图所示4类,具体选择哪一种,对药物开发机构是一项重大抉择。

图3 现有AAV基因治疗国际代表性公司及病毒载体产生策略
您肯定听说过,很久很久以前,有这样一个传说:神创造了七颗龙珠,散落在世界的各个角落。只要集齐这些龙珠并念出咒语,便可召唤出神龙帮助你实现一个愿望。
没错,集齐了上述这七颗龙珠,我们就可以正式宣布,成功推出了一款基因治疗药物!

到这里,想必您已经清楚,基因治疗药物的开发,过程漫长而曲折,期间充满了参与开发的人员——包括科学家、医生、患者、企业家等人的希望、坚持、迂回和光明。基因治疗,绝不是一个单项技术或专项学问,它汇集了临床医学、医学遗传学、分子生物学、表观遗传学、载体学、病毒学、伦理学以及实验动物等多学科知识,关联着科学家、医学家、政策专家、市场监管、产业专家等专业人士,需要研发、生产、供应链、医疗机构、CRO、GLP、营销等等各环节的配合,是科学、技术、经济、社会等方方面面综合发展的结果,无法单纯依靠个人力量推动。所以,恐怕很难听到谁是“基因治疗之父/母”的说法,倒是不时听到某位“基因治疗先驱”作报告的新闻。
不论怎样艰难,既然已经有7款药物上市,您肯定也很关心如下问题:
是不是所有的遗传病都能通过基因治疗被治愈?
常见病比如高血压、糖尿病,或者肿瘤,能基因治疗吗?
这些问题,我们都会通过后续专门的文章,一一回答。而这篇文章,是我们规划的“基因治疗的故事”系列文章的第一篇,是个序幕,在此先起个头,抛个砖,立个杆。
版权声明:
本网站所有注明"来源:华大集团"或“来源:华大医疗”的文字,图片和音视频资料,版权均属于华大集团所有。非经授权,任何媒体,网站或个人不得转载,授权转载时须注明“来源:华大集团”。本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权,或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




